Obsah
Ostatní sekceV chemii valenční elektrony jsou elektrony, které jsou umístěny v nejvzdálenějším elektronovém obalu prvku. Vědět, jak zjistit počet valenčních elektronů v konkrétním atomu, je pro chemiky důležitou dovedností, protože tato informace určuje druhy chemických vazeb, které může tvořit, a tedy i reaktivitu prvku. Naštěstí vše, co potřebujete k vyhledání valenčních elektronů prvku, je standardní periodická tabulka prvků.
Kroky
Část 1 ze 2: Hledání valenčních elektronů s periodickou tabulkou
Nepřechodové kovy
Najdi periodická tabulka prvků. Toto je barevně odlišený stůl složený z mnoha různých čtverců, které obsahují seznam všech chemických prvků známých lidstvu. Periodická tabulka odhaluje spoustu informací o prvcích - některé z těchto informací použijeme k určení počtu valenčních elektronů v atomu, který zkoumáme. Obvykle je najdete uvnitř obálky učebnic chemie. Zde je také k dispozici vynikající interaktivní tabulka online.

Označte každý sloupec na periodické tabulce prvků od 1 do 18. Obecně platí, že na periodické tabulce budou mít všechny prvky v jednom vertikálním sloupci stejný počet valenčních elektronů. Pokud vaše periodická tabulka ještě nemá každý sloupec očíslovaný, uveďte každému číslo začínající 1 pro levý konec a 18 pro krajní pravý konec. Vědecky se tyto sloupce nazývají prvek "skupiny."- Například pokud pracujeme s periodickou tabulkou, kde skupiny nejsou očíslovány, napíšeme 1 nad vodík (H), 2 nad Beryllium (Be) atd., Dokud nebudeme psát 18 nad Helium (He) .

Najděte svůj prvek na stole. Nyní najděte na stole prvek, pro který chcete najít valenční elektrony. Můžete to udělat pomocí chemického symbolu (písmena v každém poli), jeho atomového čísla (číslo v levém horním rohu každého pole) nebo jakékoli další informace, které máte v tabulce k dispozici.- Například najdeme valenční elektrony pro velmi běžný prvek: uhlík (C). Tento prvek má atomové číslo 6. Je umístěn v horní části skupiny 14. V dalším kroku najdeme jeho valenční elektrony.
- V této podsekci budeme ignorovat Přechodné kovy, což jsou prvky v bloku ve tvaru obdélníku vytvořeného skupinami 3 až 12. Tyto prvky se od ostatních trochu liší, takže kroky v této podsekci zvítězily. “ nepracuji na nich. Jak se s nimi vypořádat, viz níže.

Pomocí čísel skupin určete počet valenčních elektronů. Skupinové číslo nepřechodného kovu lze použít k nalezení počtu valenčních elektronů v atomu daného prvku. The jedno místo čísla skupiny je počet valenčních elektronů v atomu těchto prvků. Jinými slovy:- Valenční elektron 1: 1
- Skupina 2: 2 valenční elektrony
- Skupina 13: 3 valenční elektrony
- Skupina 14: 4 valenční elektrony
- Skupina 15: 5 valenčních elektronů
- Skupina 16: 6 valenční elektrony
- Skupina 17: 7 valenční elektrony
- Skupina 18: 8 valenčních elektronů (kromě helia, které má 2)
- V našem příkladu, protože uhlík je ve skupině 14, můžeme říci, že jeden atom uhlíku má čtyři valenční elektrony.
Přechodové kovy
Najděte prvek ze skupin 3 až 12. Jak již bylo uvedeno výše, prvky ve skupinách 3 až 12 se nazývají „přechodné kovy“ a chovají se odlišně než ostatní prvky, pokud jde o valenční elektrony. V této části vysvětlíme, jak do jisté míry často není možné těmto atomům přiřadit valenční elektrony.
- Například si vybereme Tantalum (Ta), prvek 73. V následujících několika krocích najdeme jeho valenční elektrony (nebo alespoň Snaž se na.)
- Uvědomte si, že mezi přechodné kovy patří řada lanthanidů a aktinidů (nazývané také „kovy vzácných zemin“) - dvě řady prvků, které jsou obvykle umístěny pod zbytkem tabulky a začínají lanthanem a aktiniem. Všechny tyto prvky patří skupina 3 periodické tabulky.
Pochopte, že přechodné kovy nemají „tradiční“ valenční elektrony. Pochopení, proč přechodové kovy ve skutečnosti „nefungují“ jako zbytek periodické tabulky, vyžaduje malé vysvětlení způsobu, jakým se elektrony chovají v atomech. Níže naleznete rychlý přehled nebo tento krok přeskočte, abyste získali správné odpovědi.
- Jak jsou elektrony přidávány k atomu, jsou tříděny do různých „orbitalů“ - v zásadě do různých oblastí kolem jádra, ve kterých se elektrony shromažďují. Valenční elektrony jsou obecně elektrony v nejvzdálenějším plášti - jinými slovy, poslední přidané elektrony .
- Z důvodů, které jsou trochu příliš složité na to, abychom je zde vysvětlili, když se elektrony přidávají k nejvzdálenějším d skořápka přechodného kovu (více o tom níže), první elektrony, které vstupují do skořápky, mají tendenci chovat se jako normální valenční elektrony, ale poté už ne, a elektrony z jiných orbitálních vrstev někdy fungují jako valenční elektrony. To znamená, že atom může mít několik počtů valenčních elektronů v závislosti na tom, jak je s ním manipulováno.
Určete počet valenčních elektronů na základě počtu skupin. Skupinové číslo prvku, který zkoumáte, vám opět může říci jeho valenční elektrony. Pro přechodové kovy však neexistuje vzor, který byste mohli sledovat - číslo skupiny bude obvykle odpovídat rozsahu možných počtů valenčních elektronů. Tyto jsou:
- Skupina 3: 3 valenční elektrony
- Skupina 4: 2 až 4 valenční elektrony
- Skupina 5: 2 až 5 valenčních elektronů
- Skupina 6: 2 až 6 valenčních elektronů
- Skupina 7: 2 až 7 valenčních elektronů
- Skupina 8: 2 nebo 3 valenční elektrony
- Skupina 9: 2 nebo 3 valenční elektrony
- Skupina 10: 2 nebo 3 valenční elektrony
- Skupina 11: 1 nebo 2 valenční elektrony
- Skupina 12: 2 valenční elektrony
- V našem příkladu, protože tantal je ve skupině 5, můžeme říci, že má mezi dva a pět valenčních elektronů, v závislosti na situaci.
Část 2 ze 2: Hledání valenčních elektronů s elektronovou konfigurací
Naučte se číst konfiguraci elektronů. Další způsob, jak najít valenční elektrony prvku, je něco, co se nazývá elektronová konfigurace. Mohou to na první pohled vypadat komplikovaně, ale jsou to jen způsob, jak reprezentovat elektronové orbitaly v atomu pomocí písmen a čísel, a jsou snadné, jakmile víte, na co se díváte.
- Podívejme se na příklad konfigurace pro prvek sodík (Na):
- 1s2s2p3s
- Všimněte si, že tato elektronová konfigurace je jen opakující se řetězec, který vypadá takto:
- (číslo) (písmeno) (číslo) (písmeno) ...
- ...a tak dále. The (číslo) (písmeno) chunk je název elektronového orbitálu a je počet elektronů v tomto orbitálu - to je ono!
- Pro náš příklad bychom tedy řekli, že sodík ano 2 elektrony na orbitě 1 s Plus 2 elektrony na 2s oběžné dráze Plus 6 elektronů na 2p oběžné dráze Plus 1 elektron na oběžné dráze 3 s. To je celkem 11 elektronů - sodík je prvek číslo 11, takže to dává smysl.
- Mějte na paměti, že každé subshell má určitou kapacitu elektronů. Jejich elektronové kapacity jsou následující:
- s: kapacita elektronů 2
- kapacita elektronu p: 6
- d: 10 elektronová kapacita
- f: kapacita elektronů 14
- Podívejme se na příklad konfigurace pro prvek sodík (Na):
Najděte konfiguraci elektronů pro prvek, který zkoumáte. Jakmile znáte elektronovou konfiguraci prvku, nalezení jeho počtu valenčních elektronů je poměrně jednoduché (samozřejmě s výjimkou přechodných kovů). Pokud vám bude konfigurace dána od začátku, můžete přejít k dalšímu kroku. Pokud ji musíte najít sami, podívejte se níže:
- Prozkoumejte úplnou konfiguraci elektronů pro oganesson (Og), prvek 118, který je posledním prvkem v periodické tabulce. Má nejvíce elektronů ze všech prvků, takže jeho elektronová konfigurace ukazuje všechny možnosti, se kterými se můžete setkat v jiných prvcích:
- 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
- Nyní, když to máte, vše, co musíte udělat, abyste našli konfiguraci elektronů jiného atomu, je vyplnit tento vzor od začátku, dokud vám nedojdou elektrony. To je jednodušší, než to zní. Například pokud chceme vytvořit orbitální diagram pro chlor (Cl), prvek 17, který má 17 elektronů, udělali bychom to takto:
- 1s2s2p3s3p
- Všimněte si, že počet elektronů se sčítá až 17: 2 + 2 + 6 + 2 + 5 = 17. Musíte změnit pouze číslo na konečné oběžné dráze - zbytek je stejný, protože oběžné dráhy před poslední jsou úplně plné .
- Další informace o elektronových konfiguracích najdete také v tomto článku.
- Prozkoumejte úplnou konfiguraci elektronů pro oganesson (Og), prvek 118, který je posledním prvkem v periodické tabulce. Má nejvíce elektronů ze všech prvků, takže jeho elektronová konfigurace ukazuje všechny možnosti, se kterými se můžete setkat v jiných prvcích:
Přiřaďte elektrony orbitálním granátům pomocí oktetového pravidla. Když jsou elektrony přidány k atomu, spadají do různých orbitalů podle výše uvedeného pořadí - první dva jdou na orbitál 1 s, dva poté na orbitál 2 s, šest poté na orbitál 2 p a již brzy. Když máme co do činění s atomy mimo přechodné kovy, říkáme, že tyto orbitaly vytvářejí kolem jádra „orbitální skořápky“, přičemž každá následující skořápka je dále ven než ty předchozí. Kromě první skořápky, která pojme pouze dva elektrony, může mít každá skořápka osm elektronů (kromě opět při obchodování s přechodnými kovy). Toto se nazývá Pravidlo oktetu.
- Řekněme například, že se díváme na prvek Boron (B). Jelikož jeho atomové číslo je pět, víme, že má pět elektronů a jeho elektronová konfigurace vypadá takto: 1s2s2p. Jelikož první oběžná dráha má pouze dva elektrony, víme, že Bor má dvě skořápky: jednu se dvěma elektrony 1 s a jednu se třemi elektrony z orbitálů 2 s a 2 p.
- Jako další příklad bude prvek jako chlór (1s2s2p3s3p) obsahovat tři oběžné dráhy: jeden se dvěma elektrony 1s, jeden se dvěma elektrony 2s a šesti elektrony 2p a jeden se dvěma elektrony 3s a pěti elektrony 3p.
Najděte počet elektronů v nejvzdálenějším plášti. Nyní, když znáte elektronové skořápky svého prvku, je nalezení valenčních elektronů snadné: stačí použít počet elektronů v nejvzdálenějším plášti. Pokud je vnější obal plný (jinými slovy, pokud má osm elektronů nebo u prvního obalu dva), je prvek inertní a nebude snadno reagovat s jinými prvky. Opět se však věci nedrží těchto pravidel pro přechodné kovy.
- Například pokud pracujeme s Boronem, protože ve druhém plášti jsou tři elektrony, můžeme říci, že Boron má tři valenční elektrony.
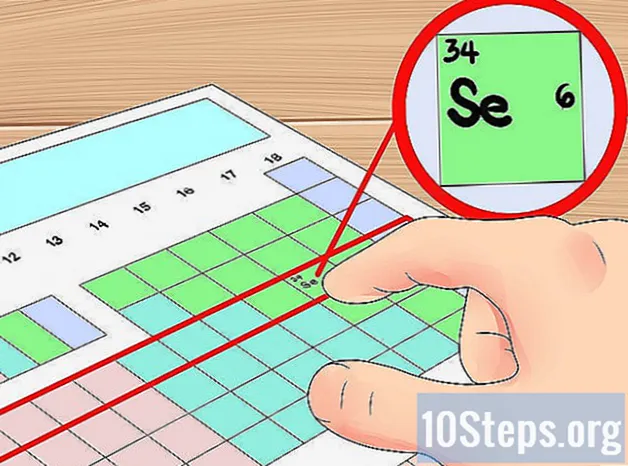
Řádky tabulky použijte jako zkratky na oběžné dráze. Vodorovné řádky periodické tabulky se nazývají prvek „období.“ Počínaje od horní části tabulky odpovídá každé období počtu elektronové skořápky atomy v období mají. Můžete to použít jako zkratku k určení, kolik valenčních elektronů má prvek - stačí začít od počítání elektronů od levé strany jeho periody. Znovu budete chtít ignorovat přechodové kovy pomocí této metody, která zahrnuje skupiny 3–12.
- Například víme, že prvek selen má čtyři orbitální skořápky, protože je ve čtvrtém období. Jelikož se jedná o šestý prvek zleva ve čtvrté periodě (ignorujeme přechodné kovy), víme, že vnější čtvrtá skořápka má šest elektronů, a tedy že selen má šest valenčních elektronů.
Otázky a odpovědi komunity
Jak vypočítáme valenční elektron?
Valenční elektrony lze nalézt určením elektronických konfigurací prvků. Poté počet elektronů v nejvzdálenějším plášti udává celkový počet valenčních elektronů v daném prvku.
Pokud má atom 33 elektronů, kolik valenčních elektronů je tam?
Pokud atom není ion, pak můžeme říci, že atom má 33 protonů. To znamená, že jde o prvek 33, který je arsen. Pak víme, že nejde o přechodný kov, a tak se podíváme a zjistíme, že jednotková číslice čísla skupiny je 5, což znamená, že má 5 valenčních elektronů.
Jak zjistím atomové číslo helia?
Počet protonů se rovná atomovému číslu.
Proč elektrony získávají záporný a ne kladný náboj?
Atomy získávají nebo ztrácejí elektrony, záporné náboje, protože protony mají kladný náboj a jsou drženy v jádru silnou jadernou silou. Toto je jedna ze čtyř odlišných sil ve vesmíru: gravitace, elektromagnetismus, slabá síla a silná jaderná síla. Musí to být silné, protože protony se navzájem odpuzují, přesto jsou v jádru opravdu blízko sebe (spolu s neutrony, také drženými silnou silou.) Myšlenka je, že silná síla je extrémně silná, ale jen na velmi malé vzdálenosti. Mysli na drobné super silné háčky. Chcete-li, aby se protony a neutrony spojily, potřebujete síly, jako je obrovská gravitace hvězdy, supernova nebo jaderný výbuch.
Jaký je záclonový elektron vzácných plynů?
Vzácné plyny mají osm valenčních elektronů - nejstabilnější stav prvku.
Proč má dusík 6 záclonových elektronů, ale je ve skupině 15?
Dusík má pouze pět záclonových elektronů, protože je ve skupině 5, i když ve skutečnosti ve skupině 15 budete ignorovat přechodné kovy, protože tyto skupiny mají odlišný způsob určování svých valenčních elektronů. Proto: skupina 13 znamená skupinu 3 atd.
Atom má 7 protonů, 8 neuronů a 7 elektronů. Jaký je počet elektronů v jeho valenčním plášti?
Prvek, který obsahuje 7 protonů, je dusík. Dusík je ve sloupci prvků, které mají ve valenčním plášti 5 elektronů. Počet neutronů je irelevantní pro zjištění počtu valenčních elektronů v konkrétním prvku.
Kde na periodické tabulce jsou atomy se sedmi elektrony vnějšího obalu?
Podívejte se do předposledního sloupce na pravé straně vedle inertních plynů.
Co je to valenční elektron?
Valenční elektron je elektron, který se nachází na nejvzdálenější části atomu a může být sdílen nebo přijat v reakci.
Proč mají prvky v periodické tabulce různý počet valenčních elektronů?
Mají různé chemické struktury. Valenční elektrony vytvářejí chemické reakce.
Tipy
- Všimněte si, že elektronové konfigurace lze zapsat jakousi zkratkou pomocí ušlechtilých plynů (prvků ve skupině 18), které zastupují orbitaly na začátku konfigurace. Například, sodíkovou elektronovou konfiguraci lze napsat 3s1 - v podstatě je to stejné jako neon, ale s dalším elektronem na 3s orbitálu.
- Přechodné kovy mohou mít valenční podškrty, které nejsou zcela zaplněny. Stanovení přesného počtu valenčních elektronů v přechodných kovech zahrnuje principy kvantové teorie, které přesahují rámec tohoto článku.
- Pamatujte, že periodické tabulky se v jednotlivých zemích liší. Zkontrolujte tedy, zda používáte správný, aktualizovaný, abyste předešli nejasnostem.
- Ujistěte se, že víte, kdy přidat nebo odečíst od posledního orbitálu pro nalezení valenčních elektronů.
Věci, které budete potřebovat
- Periodická tabulka prvků
- Tužka
- Papír
Každý den na wikiHow tvrdě pracujeme, abychom vám poskytli přístup k instrukcím a informacím, které vám pomohou žít lepší život, ať už vás to udrží v bezpečí, zdravější, nebo vám zlepší pohodu. Uprostřed současné zdravotní a ekonomické krize, kdy se svět dramaticky mění a my se všichni učíme a přizpůsobujeme se změnám v každodenním životě, lidé potřebují wikiHow více než kdy jindy. Vaše podpora pomáhá wikiHow vytvářet podrobnější ilustrované články a videa a sdílet naši důvěryhodnou značku instruktážního obsahu s miliony lidí po celém světě. Zvažte, prosím, přispět na wikiHow ještě dnes.


