Autor:
Mike Robinson
Datum Vytvoření:
7 Září 2021
Datum Aktualizace:
11 Smět 2024
Obsah
Atomové číslo odpovídá počtu protonů v jádru jednoho atomu prvku. Tato hodnota se nemění; proto jej můžete použít k objevení dalších charakteristik izotopu, jako je počet neutronů.
Kroky
Část 1 ze 2: Nalezení atomového čísla
Najděte kopii periodické tabulky. Pokud žádný nemáte, klikněte sem. Každý prvek má své vlastní atomové číslo; neexistují tedy žádné zkratky k učení obsahu. Použijte kopii tabulky nebo si ji zkuste zapamatovat.
- Většina knih o chemii má tabulku vytištěnou na zadní obálce.

V tabulce vyhledejte prvek, který studujete. Většina tabulek obsahuje celé jméno prvků a jejich symboly (například Hg pro rtuť). Pokud nemůžete najít, co hledáte, přejděte online a vyhledejte výrazy „chemický symbol“ a název prvku.
Najděte atomové číslo prvku. Obvykle je v levém nebo pravém horním rohu domu prvku, ale může se objevit i na jiných místech. Kromě toho se vždy jedná o celočíselnou hodnotu.- Pokud číslo obsahuje desetinnou čárku, znamená to pravděpodobně atomovou hmotnost.
Potvrďte informace podle prvků v okolí. Periodická tabulka je organizována podle pořadí atomových čísel. Pokud je vaše číslo izotopu například „33“, bude prvek vlevo mít „32“ a prvek vpravo bude „34“. V takovém případě je to proto, že se díváte na atomové číslo.
- Mezi prvky „56“ (baryum) a „88“ (rádio) je skok. Izotopy, které odpovídají tomuto rozsahu, jsou ve dvou řádcích pod tabulkou. Jsou odděleny pouze takto, aby stůl nebyl příliš velký.

Pochopte, co atomové číslo znamená. Atomové číslo má jednoduchou definici: množství protonů v atomu prvku. Toto množství protonů zase určuje celkový elektrický náboj jádra - což následně určuje, kolik elektronů může atom nabít. Protože elektrony jsou zodpovědné za téměř všechny chemické interakce, atomové číslo nepřímo ovlivňuje fyzikální a chemické vlastnosti prvku.- Jinými slovy, každý atom s osmi protony odpovídá atomu kyslíku. Dva atomy kyslíku mohou mít různý počet neutronů nebo (je-li jeden ion) nebo elektronů, ale vždy budou mít každý osm protonů.
Část 2 ze 2: Objevování důležitějších informací
Určete atomovou hmotnost. Obvykle přichází pod názvem prvku v periodické tabulce a má dvě nebo tři desetinná místa. Atomová hmotnost odpovídá průměrné hmotnosti atomů prvku, což představuje způsob, jakým se nachází v přírodě. Měří se v „jednotkách atomové hmotnosti“ („u“ nebo „u.m.a“).
- Mnoho vědců dává přednost použití výrazu „atomová hmotnost“ místo hmotnosti.
Pochopte atomovou hmotnost. Koncept atomové hmotnosti je velmi podobný konceptu hmotnosti. Rozdíl je v tom, že hmotnost označuje průměrnou hmotnost libovolného atomu v prvku, nikoli konkrétního atomu. Například: gram železa obsahuje několik atomů s různou hmotností; hmotnost udává jejich „relativní hmotnost“. Pokud studujete jediný atom prvku, potřebujete znát jeho specifickou hmotnost.
- Obecně platí, že chemické problémy týkající se samotných atomů již informují o počtu atomových hmot. Musíte pochopit koncept, abyste nebyli zaskočeni, když uvidíte jinou hodnotu.
Zaokrouhlete číslo hmotnosti. Hmotnostní číslo odpovídá celkovému množství protonů a neutronů v atomu prvku. Není těžké to vypočítat: stačí vzít atomovou hmotnost vytištěnou na periodické tabulce a zaokrouhlit ji na nejbližší celou hodnotu.
- Funguje to proto, že množství neutronů a protonů se velmi blíží 1 pm, zatímco množství elektronů je velmi blízké nule. Atomová hmotnost zahrnuje přesné výpočty k určení desítkové hodnoty, ale důležitá jsou pouze celá čísla, která vám řeknou, kolik protonů a neutronů existuje.
- Pamatujte, že pokud použijete atomovou hmotnost, budete se potýkat s váhou konkrétního atomu v prvku. Například vzorek bromu má atomovou hmotnost 79 nebo 81.
Vypočítejte počet neutronů. Nyní již víte, že atomové číslo se rovná počtu protonů a že hmotnostní číslo se rovná součtu počtu protonů a neutronů. Chcete-li určit množství neutronů v prvku, jednoduše odečtěte atomové číslo od této celkové hmotnosti. Nějaké příklady:
- Atom helia (He) má hmotnostní číslo 4 a atomové číslo 2. Proto 4 - 2 = 2 neutrony.
- Vzorek stříbra (Ag) má průměrné hmotnostní číslo 108 (podle periodické tabulky) a atomové číslo 47. V průměru má každý atom ve vzorku 108 - 47 = 61 neutronů.
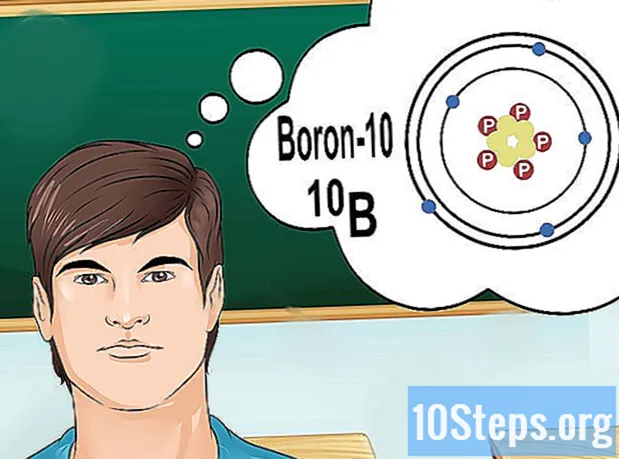
Pochopte izotopy. Izotop je specifická forma prvku, který obsahuje řadu neutronů. Pokud problém, který chcete vyřešit, přináší něco jako „bór-10“ nebo „B“, je to proto, že hovoříte o prvcích boru s hromadným číslem 10. Použijte tuto hodnotu, ne „normální“ hodnoty boru.
- Atomový počet izotopů se nikdy nemění. Každý izotop prvku má stejný počet protonů.
Tipy
- Atomová hmotnost některých těžších prvků je uvedena v závorkách nebo hranatých závorkách. To znamená, že tato hmotnost je přesnou hmotou nejstabilnějšího izotopu, nikoli průměrem několika izotopů. Nakonec to neovlivní atomové číslo prvku.


